Introducción
El principal trastorno del estado de ánimo es la depresión mayor (DM). La literatura especializada sobre el tema contiene varias revisiones que abordan distintos aspectos como su epidemiología, genética, etiología y fisiopatología.1,2 Sin embargo, no se ha propuesto una posible conexión entre los más recientes hallazgos a nivel celular y molecular, con los cambios anatómico-funcionales que ocurren en el cerebro de los pacientes con DM. Los objetivos de esta revisión son: 1. proponer una visión integral sobre la fisiopatología de la DM y los mecanismos de acción de los fármacos antidepresivos y 2. discutir la evidencia reciente que sustenta a las dos hipótesis neurobiológicas de la DM: la monoaminérgica, con énfasis en el componente serotoninérgico, y la neurotrófica.
Métodos
La búsqueda bibliográfica se hizo en PubMed empleando las siguientes palabras clave: depresión mayor, fármacos antidepresivos, serotonina, estrés y neuronas. Los criterios de inclusión fueron: i) publicaciones enfocadas en la fisiopatología molecular, celular y sistémica de la DM; ii) estudios experimentales en neuronas aisladas y/o in situ, sobre los mecanismos de acción de los fármacos antidepresivos; iii) estudios farmacológicos pre-clínicos y clínicos; iv) trabajos publicados en su mayoría en los últimos 10 años.
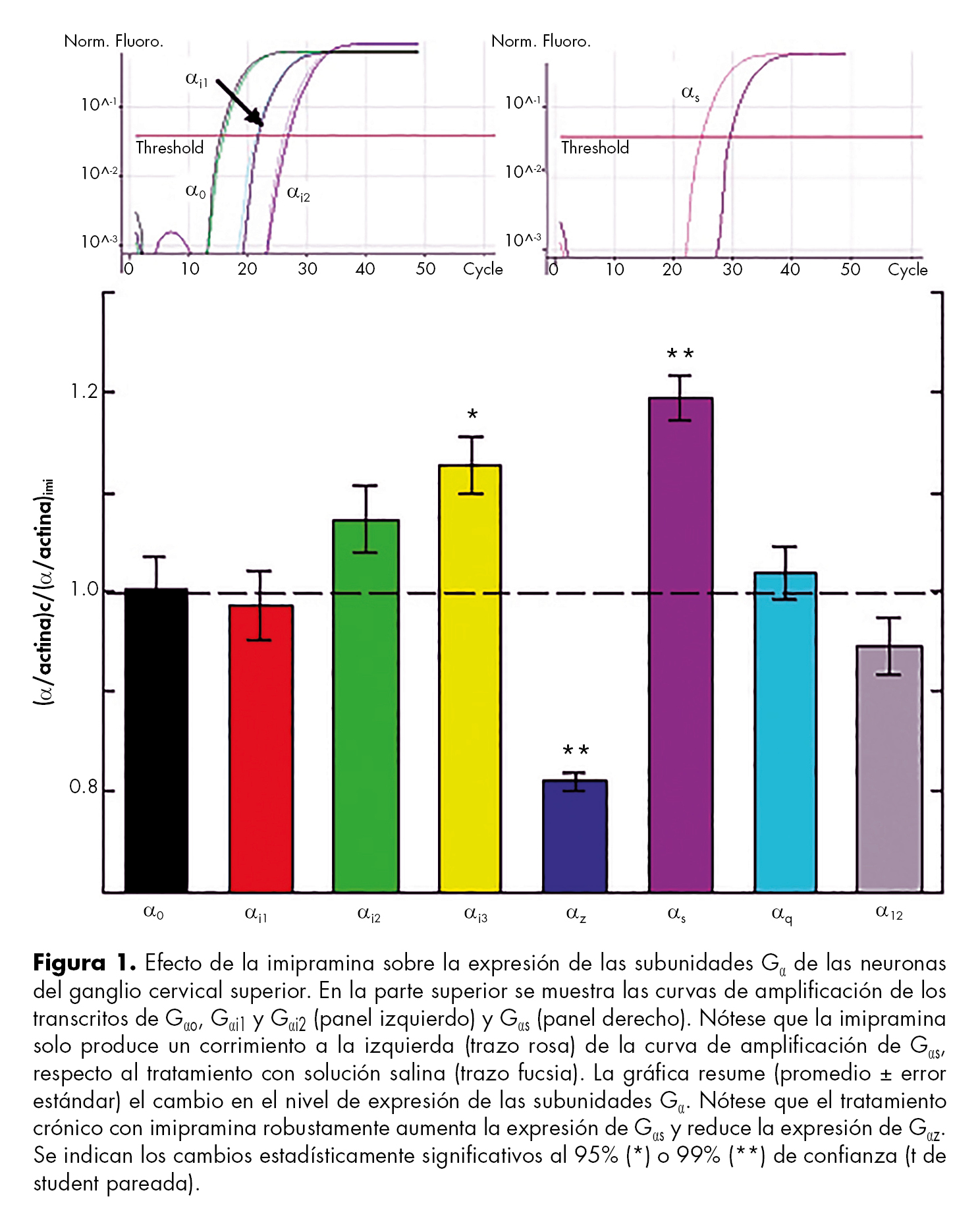
Como se discute en la presente revisión, la fisiopatología de la DM incluye un mecanismo neurotrófico. En este contexto hay evidencia de que las proteínas G heterotriméricas (proteínas G) regulan las vías de señalización intracelular activadas por receptores a factores neurotróficos, convirtiendo a las proteínas G como posibles blanco molecular de los fármacos antidepresivos. Por lo anterior, un objetivo adicional de este trabajo es reportar el efecto del antidepresivo imipramina sobre la expresión de las subunidades α (Gα) de las proteínas G. Por lo tanto, los resultados de la figura 1 se obtuvieron empleando la siguiente metodología: se inyectaron seis ratas macho (Wistar; 3 semanas) por vía intraperitoneal con solución salina (n = 3) o imipramina (n = 3) (10 mg/Kg) por 21 días. Después, se anestesiaron y decapitaron para disecar los ganglios cervicales superiores. El protocolo fue aprobado por el Comité de Ética y Bioseguridad de la Universidad de Colima. Se removió la cápsula de tejido conectivo y cada par de ganglios se depositaron en tubos de PCR con 1 ml de trizol. La transcripción inversa se realizó con el kit SuperScript TM III (Invitrogen). Para la PCR en tiempo real se utilizó el kit LightCicler Fast Start DNA MasterPLUS SYBR Green I (Roche) y el termociclador LightCycler 1.5 (Roche); los primers se diseñaron con salto de intrón. De las curvas de amplificación se obtuvo el parámetro “Ct” para normalizar la expresión de cada Gα (α) a la del gen constitutivo (actina). La expresión relativa (α/actina) se empleó para cuantificar el cambio en la expresión, dividiendo el valor obtenido en las ratas inyectadas con solución salina (α/actina)c entre el valor con imipramina (α/actina)imi; si el cociente es mayor a uno significa aumento en la expresión y viceversa.
Síntomas de la depresión mayor y criterios de diagnóstico
La DM se caracteriza por episodios en los que las emociones y pensamientos negativos coexisten con déficit cognitivo y alteraciones en el apetito, la libido y el sueño. El instrumento de diagnóstico preferido en los Estados Unidos de América y en México es el Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-IV). El manual incluye los siguientes síntomas: sentimientos de tristeza, desesperanza, inutilidad y culpa; baja autoestima; pensamientos negativos centrados en el suicidio; déficit cognitivo afectando la motivación, la atención selectiva, la memoria episódica y de trabajo y una menor capacidad de pensamientos reflexivos; irritabilidad, disforia y anhedonia. Los síntomas neurovegetativos incluyen menor o mayor apetito, fatiga y alteraciones del ciclo vigilia-sueño. El diagnóstico se establece cuando al menos cinco de los anteriores síntomas coexisten y persisten por lo menos durante dos semanas. En el 2013 apareció el DSM-5, el cual preserva el núcleo de síntomas pero se reconoce la comorbilidad con la ansiedad; otra novedad es que elimina el criterio de exclusión del duelo. En cualquier caso, el diagnóstico sigue siendo subjetivo dificultando el estudio de la etiología, la fisiopatología y el tratamiento de la DM. Sin embargo, los avances en las neurociencias eventualmente permitirán reformular desde bases más científicas (v. gr. proponiendo marcadores moleculares o biológicos) la nosología y etiología de los trastornos depresivos. La DM causa severa discapacidad en el contexto ocupacional, educativo y social, y se estima que en el año 2020 será la segunda causa de discapacidad en la población mundial y seguirá siendo la primera en los países industrializados.3,4
Epidemiología y factores de riesgo
En México, la encuesta de epidemiología psiquiátrica del 2002-2003 estimó una prevalencia del 4.5% en la población adulta y de 1.7% antes de los 18 años.5,6 Globalmente la prevalencia en la mujer es mayor que en el hombre, en una proporción de 2:1. Por ejemplo, en México la prevalencia en la población adulta es de 5.8% en mujeres y 2.5% en hombres y esta proporción se mantiene para la DM con inicio temprano (2.4% en mujeres y 1.0 % en hombres).5,6
El consenso actual es que la DM se origina por la interacción de factores genéticos, epigenéticos y ambientales que eventualmente alteran la bioquímica, la citoarquitectura y la función de áreas específicas del cerebro.7,8,9,10 Aquí se analizan dos polimorfismos por su posible relevancia fisiopatológica: i) el polimorfismo G1463A del gen para la enzima triptófano hidroxilasa tipo 2 humana (hTPH2) y ii) el polimorfismo C(-1019)G en el gen del receptor a la serotonina (5-HT) 5-HT1A. Dentro de los factores medioambientales se considera al estrés crónico (físico o psicológico) como factor de riesgo para la DM. Esta asociación parte de la observación de que cerca del 50% de los individuos con DM muestran hipercortisolemia.11,12,13 Estos hallazgos sugieren que la disregulación del eje hipotálamo-pituitaria-corteza adrenal (HPA) es un factor neuroendócrino que contribuye a la etiología de la DM.14
Cambios anatómicos y metabólicos en el cerebro de individuos con DM
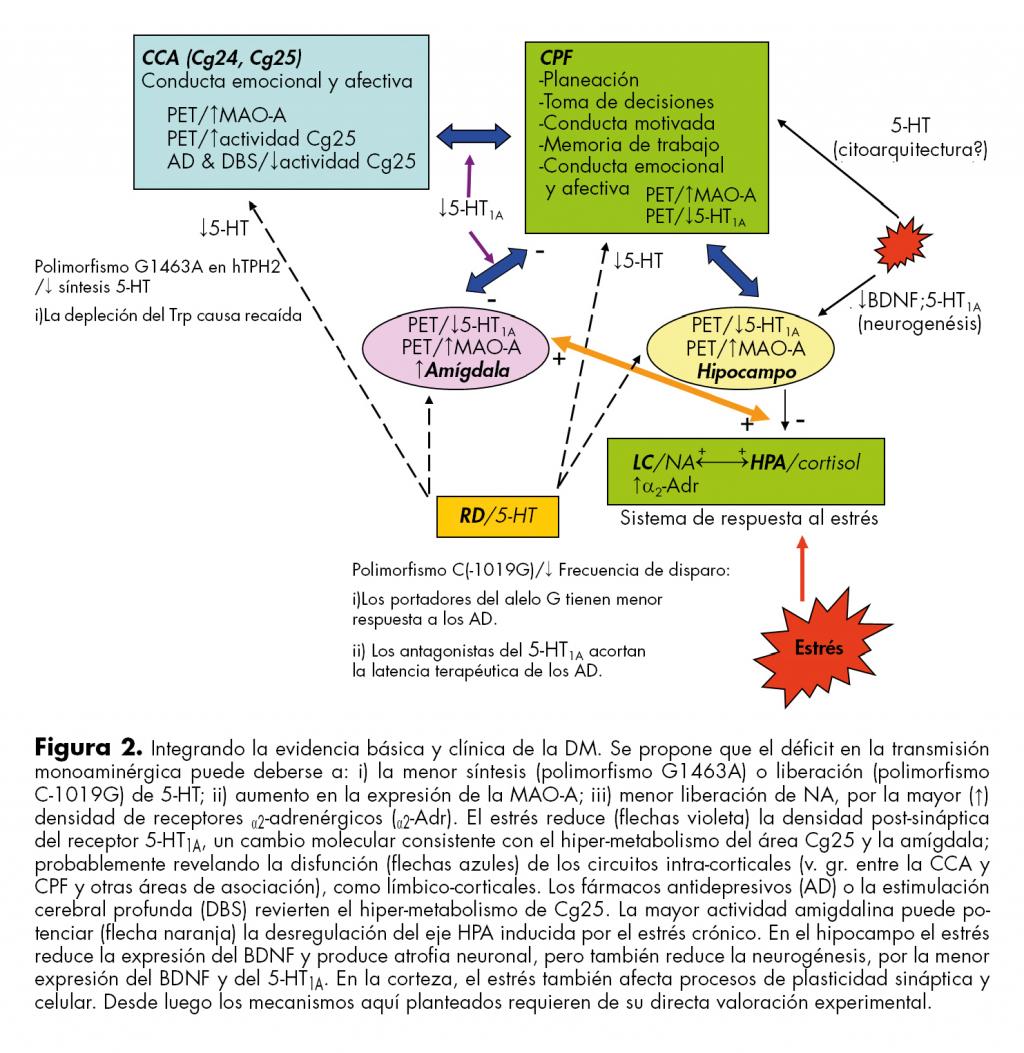
La heterogénea sintomatología de la DM sugiere la participación de distintas áreas cerebrales. Por citar sólo dos, la disfunción de la corteza prefrontal (CPF) dorsolateral estaría afectando funciones cognitivas como el razonamiento, la planeación y la toma de decisiones (figura 2). Por su parte, las áreas orbitofrontal y medial de la CPF, al participar en la regulación de la experiencia emocional, contribuirían al componente afectivo del síndrome. A continuación se discuten los hallazgos obtenidos con imágenes cerebrales por resonancia magnética (RM) y/o tomografía por emisión de positrones (PET), revelando las anormalidades anatómico-funcionales más frecuentes.
Cambios en el volumen cortical y subcortical: estudios con RM
Uno de los cambios estructurales es la reducción del hipocampo.15,16,17,18,19 El decremento promedio es del 8-10%, siendo el cambio tanto bilateral como sólo en uno de los hemisferios. También se reporta una reducción significativa unicamente en pacientes que tuvieron episodios depresivos recurrentes,18 o bien el decremento se correlaciona inversamente con la duración del episodio depresivo.19 Otros estudios no reportan cambios en el volumen hipocampal, ni tampoco confirman la relación inversa entre la duración del episodio depresivo y el grado de reducción del volumen.16,20 Esta evidencia limita la importancia fisiopatológica de la reducción del hipocampo: i) los pacientes en remisión siguen mostrando menor volumen hippocampal;21 ii) la reducción también se observa en la esquizofrenia y en el trastorno bipolar,16,22 es decir, este cambio neuroanatómico no es exclusivo de la DM. Para conciliar estas observaciones se propone que la reducción del hipocampo no causa el primer episodio depresivo pero se convierte en un factor de recurrencia y de eventual cronicidad del síndrome depresivo.23
Otra área donde también se reduce la materia gris es la corteza cingulada anterior (CCA), específicamente en la zona ventral al genu del cuerpo calloso (corteza subgenual). La reducción es prominente (20-40%) en pacientes con antecedentes familiares de DM.24 También la RM revela menor volumen de materia gris en la CPF orbital.25 Estas observaciones in vivo concuerdan con estudios post-mortem. Por ejemplo, Öngür26 encontró menor número de células gliales en la corteza subgenual Cg24; la reducción es más pronunciada en sujetos con DM (24%) o enfermedad bipolar (41%) con un claro perfil familiar. En este estudio los pacientes con esquizofrenia no mostraron variación de la densidad celular, sugiriendo que la menor densidad glíal es una anormalidad relacionada con la DM y otros síndromes afectivos. Cabe mencionar que la corteza subgenual y la CPF orbital al procesar información de las áreas de asociación sensorial, como de la corteza insular, la integran para generar la conducta emocional y afectiva.27,28
Cambios funcionales en la DM: estudios con PET
En coincidencia con el menor volumen de la corteza subgenual, el PET revela una menor actividad metabólica en esta área cortical.29 Sin embargo, cuando la imagen se corrige por el menor volumen, el área Cg25 revela hiper-metabolismo respecto de los individuos control.16 Es muy probable que esta hiperactividad contribuye a la conducta depresiva porque: 1. cuando a individuos sanos se les provoca un sentimiento de profunda tristeza también aumenta la actividad de Cg25,30 2. los fármacos antidepresivos reducen el hiper-metabolismo de Cg25 o de otras áreas de la CPF, tanto en individuos con DM como en pacientes depresivos con enfermedad de Parkinson,16,31,32,33,34 3. la estimulación eléctrica de Cg25 revierte la sintomatología depresiva.35,36
En la amígdala también aumenta la actividad metabólica.37 Esta alteración funcional no ocurre en la esquizofrenia o en síndromes de ansiedad como el obsesivo-compulsivo, las fobias y el trastorno de pánico.7 Hay evidencia de que el aumento de la actividad amigdalina antecede a la recaída de la sintomatología depresiva en pacientes bajo el protocolo de depleción del triptófano.38
Neurobiología de la depresión mayor
La hipótesis monoaminérgica. Esta hipótesis es el marco conceptual predominante que aborda la fisiopatología de la DM y establece que el síndrome se origina por la menor disponibilidad de monoaminas en el cerebro, principalmente de 5-HT y noradrenalina (NA). La hipótesis originalmente se basa en que la mayoría de los fármacos antidepresivos aumentan el nivel cerebral de 5-HT y NA mediante la inhibición de su recaptura o de su degradación enzimática. Estudios recientes aportan mayor sustento a la hipótesis. Por ejemplo, imágenes con PET revelan que los pacientes con DM muestran mayor expresión de la monoamino-oxidasa A (MAO-A) en la CPF, la corteza temporal, el hipocampo, el tálamo, el núcleo accumbens (NAc) y el mesencéfalo.39 Este hallazgo hace suponer que la mayor tasa de degradación de 5-HT y NA es uno de los mecanismos fisiopatológicos que atenúa la transmisión monoaminérgica. Por su parte, el polimorfismo G1463A en el gen de la hTPH2 sugiere que el déficit serotoninérgico reside en la síntesis de 5-HT, ya que el correspondiente cambio de aminoácido resulta en la pérdida del 80% de la función enzimática.40 La asociación con la DM se confirma cuando en un grupo de 87 pacientes, el 10% portaba el polimorfismo G1463A, un porcentaje significativamente mayor al valor encontrado (1%) en la muestra (n=219) de individuos sanos.40 Una evidencia clínica que apoya la hipótesis monoaminérgica proviene de estudios en pacientes sometidos al protocolo de depleción del triptófano (Trp) cerebral. Una predicción del paradigma es que la depleción facilita la recaída depresiva sólo en aquellos pacientes que respondieron al tratamiento con los inhibidores selectivos de la recaptura de 5-HT (SSRIs). Un meta-análisis de 45 estudios publicados hasta el 2006 revela resultados consistentes con la hipótesis.41
Es limitado el número de estudios cuando se reduce el nivel cerebral de NA y dopamina, sin embargo los datos apuntan en la misma dirección que en la depleción del Trp.41,42 Una evidencia a favor del componente noradrenérgico proviene de estudios post-mortem en donde se midió la unión de un ligando del transportador de NA en el locus coeruleus (LC). En una muestra de pacientes con DM se encontró una menor densidad del transportador respecto a los sujetos control.43 Se postula que este cambio es resultado de la menor biodisponibilidad de la NA en la sinapsis, lo que es plausible considerando que la mayor expresión de la MAO-A en el mesencéfalo39 estaría incrementando la degradación enzimática de la NA. Otro estudio en el LC reporta aumento en la densidad de receptores α2-adrenérgicos (su impacto funcional se discute más adelante).44
La hipótesis neurotrófica. Esta hipótesis propone que la DM también se debe a la atrofia neuronal producto de la menor expresión del factor de crecimiento derivado del cerebro (BDNF).45 También propone que el estrés crónico disregula al eje HPA propiciando la exposición sostenida del tejido nervioso al cortisol y, con ello, la inhibición de la expresión del BDNF.7 Estudios post-morten aportan evidencia del mecanismo neurotrófico, pues se ha observado una menor expresión del BDNF y de su receptor TrkB en el hipocampo y la CPF de pacientes con DM, respecto a individuos sin padecimiento psiquiátrico al momento del deceso.46 Otro estudio reporta que pacientes con DM bajo tratamiento farmacológico muestran una mayor expresión del BDNF en el hipocampo, comparado con pacientes sin tratamiento.47
El resto de la evidencia proviene de estudios en roedores sometidos a estrés crónico. Un efecto común de los paradigmas de estrés es la menor expresión del BDNF y de su receptor TrkB en el hipocampo, mientras que la administración crónica de antidepresivos revierte el efecto del estrés sobre ambas proteínas.48,49,50 Además, los antidepresivos reducen el daño inducido por el estrés sobre la arborización dendrítica de las neuronas piramidales del hipocampo51,52 y estimulan la neurogénesis.53,54
La evidencia conductual proviene de modelos murinos de conducta depresiva. Por ejemplo, se cree que la prueba del nado forzado (FST por sus siglas en inglés) mimetiza la conducta de desesperanza del humano, y a pesar de su simpleza metodológica tiene gran valor predictivo de la eficacia terapéutica de los antidepresivos.55 Con la FST se reporta que la inyección de BDNF (un día antes de la prueba) en el hipocampo de la rata tiene efecto antidepresivo con eficacia similar al tratamiento farmacológico.56 Sin embargo, este efecto conductual agudo del BDNF contrasta con el hecho de que sólo el tratamiento crónico (21 días) con antidepresivos aumenta la expresión del BDNF y su receptor en esta misma especie.49 Es decir, el desfase entre el efecto conductual en la FST y génico del BDNF debe tomarse con reserva como sustento de la hipótesis neurotrófica.
Receptores y rutas de señalización alteradas en la DM
A continuación se discute la posible relevancia fisiopatológica del receptor 5-HT1A, un receptor que señaliza vía la familia Gi de las proteínas G, ya que dependiendo de su densidad y localización pre- o post-sináptica tiene un impacto diferencial en el déficit de la transmisión serotoninérgica.
A) Auto-receptor 5-HT1A
El polimorfismo C(-1019)G en el promotor del gen del receptor 5-HT1A revela otro mecanismo fisiopatológico de la DM. Este cambio de nucleótido provoca su transcripción diferencial en el SNC, pues los portadores del alelo G tienen mayor densidad del receptor en el rafé dorsal (RD) y mayor asociación con la DM.57 El grado de expresión del auto-receptor depende de la composición alélica, acorde con el genotipo CC
Aun cuando no hay una prueba directa del anterior mecanismo fisiopatológico, sí hay alguna evidencia clínica que lo apoya. Por ejemplo, se sabe que los antagonistas del 5-HT1A reducen la latencia terapéutica de los antidepresivos.61,62 Esta sinergia clínica obedece a que los SSRIs desensibilizan al auto-receptor 5-HT1A por un mecanismo que implica su desacoplamiento con la proteína G y no vía la disminución en la densidad del receptor.63,64,65 En conclusión, la atenuación de la señalización del auto-receptor 5-HT1A puede lograrse a través de la desensibilización o por medio de sus antagonistas. En ambos casos el resultado es que las neuronas del RD se liberan de su auto-inhibición.
B) Receptor post-sináptico 5-HT1A
Estudios con PET en pacientes no tratados con antidepresivos revelan consistentemente una menor densidad del receptor 5-HT1A en la CPF, el hipocampo y la amígdala.66,67,68,69 Este cambio molecular también ocurre en la CCA tanto de pacientes cuyo diagnóstico es algún síndrome de ansiedad, como en aquellos que padecen ansiedad y depresión.70,71 Esto es de esperarse porque la co-morbilidad entre la ansiedad y la depresión es la regla.30
Los receptores a la 5-HT que mayormente se expresan en la CPF son el 5-HT1A y el 5-HT2A; el primero se localiza en el soma y las dendritas basales de las neuronas piramidales, mientras que el segundo se ubica en la dendrita apical.72,73,74 En estas neuronas el 5-HT1A estimula un eflujo de K+ a través de canales tipo GIRK.72,73,75 La acción inhibitoria incluye a las neuronas de las capas II y III de la CPF.75 Por lo tanto, la menor densidad post-sináptica del 5-HT1A puede implicar que en la DM suceda una alteración en el procesamiento de la información intracortical e interhemisférica, así como en la retroalimentación entre la corteza y el sistema límbico ( figura 2). Esta disfunción explicaría ciertos hallazgos realizados por fMRI que revelan un decremento en la comunicación entre la amígdala y la CCA.23 La menor densidad del receptor 5-HT1A en la amígdala también es consistente con la mayor actividad amigdalina de los pacientes con depleción del Trp.38 En concordancia con todo lo anterior se sabe que los antidepresivos o el tratamiento electroconvulsivo aumentan, directa o indirectamente, la señalización del receptor 5-HT1A.74
La manipulación génica en el roedor de las proteínas que participan en la señalización del receptor 5-HT1A también fundamenta su papel relevante en la conducta anti- (mayor función) o pro-depresiva (menor función). Por ejemplo, al prolongar la señalización de este receptor, ya sea por una mutación en la subunidad Gαi2 que impide su interacción con las proteínas RGS,76 o eliminando la expresión de RGS6,77 el fenotipo obtenido son ratones con conducta antidepresiva y ansiolítica. Desde luego se requiere mayor conocimiento sobre cómo el receptor 5-HT1A regula la comunicación entre las áreas corticales y con el sistema límbico ( figura 2), para elaborar hipótesis más precisas sobre su papel en la conducta afectiva y cognitiva.
La menor densidad post-sináptica del 5-HT1A no se deriva de un mecanismo de “regulación a la baja” secundario a un déficit en la liberación de 5-HT, porque la lesión del RD no altera su densidad en la corteza y el hipocampo.68 En cambio, el eje HPA sí regula su expresión porque la extirpación, en la rata, de las glándulas adrenales aumenta el transcrito del receptor en el hipocampo, en donde el 5-HT1A se co-localiza con los receptores a glucocorticoides.78,79 En congruencia con lo anterior se reporta, en un modelo de estrés social, que las ratas subordinadas a un macho dominante muestran un mayor nivel de corticoesteroides y una menor densidad de los receptores 5-HT1A en el hipocampo.80 En otro estudio se encontró que el estrés en la rata adulta atenúa la señalización del receptor 5-HT1A en la corteza cerebral, siempre y cuando el roedor sea sometido a estrés a edad temprana.75 En el hipocampo el receptor 5-HT1A estimula la proliferación,81 por lo que su menor densidad afectaría la neurogénesis.
C) Receptores 5-HT2
Los subtipos de receptor 5-HT2 que se expresan con mayor abundancia en el cerebro son el 5-HT2A y el 5-HT2C. El 5-HT2A se expresa en el sistema límbico y la CPF, sin embargo la evidencia sobre el sentido en que cambia su densidad en la DM es controversial ya que se reportan tanto un aumento como una disminución, o incluso sin cambio.82,83,84 Al receptor 5-HT2A se le relaciona más con la esquizofrenia (el antipsicótico atípico clozapina es un antagonista de este receptor) o con estados alterados de la conciencia como las alucinaciones (el LSD es un agonista de este receptor).
D) Receptores a la NA
Como ya se mencionó, pacientes con DM sin prescripción o sin trazos de antidepresivos al momento del deceso, revelan un aumento robusto en la densidad del receptor α2-adrenérgico en el LC.44 En el RD la densidad de este receptor no cambia, descartando que su aumento en el LC sea una respuesta compensatoria al déficit noradrenérgico. La mayor expresión del receptor α2-adrenérgico en el LC estaría reduciendo la liberación de NA en la corteza y el sistema límbico, debido a que al ubicarse pre-sinápticamente inhibe a los canales de calcio que median la liberación de neurotransmisores.85,86
Tratamiento de la DM y el mecanismo de acción de los fármacos antidepresivos
Los fármacos antidepresivos son la primera elección terapéutica,87,88 sin embargo, su eficacia es limitada ya que en promedio la tercera parte de los pacientes no responden a él.7 Otras estrategias clínicas incluyen a la terapia electroconvulsiva, la estimulación del nervio vago, la estimulación cerebral profunda o la estimulación magnética transcraneal. Una discusión del tratamiento no farmacológico puede verse en otras revisiones.30,35
El desfase entre la acción farmacológica y terapéutica de los antidepresivos
Los antidepresivos se clasifican en: i) inhibidores selectivos de la recaptura de 5-HT (SSRIs: fluoxetina, citalopram, etc) o de la NA (NSRIs: desipramina, reboxetina); ii) de ambas monoaminas (tricíclicos: imipramina, nortriptilina); iii) inhibidores de la MAO-A (tranilcipromina, selegilina, etc). No obstante, uno de los enigmas del tratamiento farmacológico es su desfase con la acción terapéutica (de 4 a 6 semanas). Al respecto se postula que los antidepresivos inducen adaptaciones moleculares de mayor latencia y duración que están más relacionadas con su acción terapéutica. Se han logrado avances en esta dirección inyectando crónicamente (durante 2 a 3 semanas) en el roedor dosis terapéuticas del fármaco.
A) Efecto sobre la vía del AMPc
Hay suficiente evidencia de que en la DM la vía AMPc/proteína cinasa A (PKA)89,90 es disfuncional, al igual que los procesos de plasticidad sináptica y celular dependientes del AMPc, como la potenciación postetánica a largo plazo, el crecimiento de neuritas, la sinaptogénesis o la neurogénesis.90 Uno de los efectos moleculares de los antidepresivos es la estimulación de la vía AMPc/PKA en la corteza cerebral, el hipocampo y la amígdala.91,92 Dado que entre las proteínas fosforiladas por la PKA están el factor de transcripción CREB,93,94 el cual estimula la expresión del BDNF y de su receptor TrkB,49 y la proteína MAP2 la cual estimula la despolimerización de los microtúbulos,89,92 se propone que parte del efecto terapéutico se debe a la estimulación de los procesos de plasticidad sináptica y celular antes referidos.90
B) Efecto sobre la expresión de las proteínas G
Las proteínas G heterotriméricas (Gαβγ) son las moléculas que primero se consideraron como posibles blancos moleculares de los antidepresivos. Esto es porque la 5-HT y NA estimulan a los receptores acoplados a estos transductores de información, con la excepción del 5-HT3. La mayor parte de los estudios publicados fueron hechos con las técnicas de western blot o ELISA. Así, en el hipotálamo la fluoxetina reduce la inmunoreactividad a Gαi1 (38%) y Gαz (27%), mientras que Gαi3, Gαi2 y Gαo permanecen sin cambio.95 En el neoestriado y el LC la imipramina, la clomipramina o la desipramina reducen (20-40%) la inmunoreactividad de Gαs.96 En contraste, no hay efecto sobre la expresión de Gαs, Gαi1,2, Gαq/11 en la corteza y/o el hipocampo, por la desipramina,97,98 amitriptilina97,99 o fluoxetina.100 Prácticamente no hay estudios que evalúen la expresión de los transcritos de las Gα. Uno de ellos emplea la técnica de northern blot y reporta que la amitriptalina y desipramina no afectan la expresión de Gαs y Gαi1/2 en la corteza cerebral.99 Otro estudio con PCR convencional muestra que la imipramina y la fluoxetina no tienen efecto sobre la expresión de Gαs Gαi1/2, Gαo y Gαq en la corteza frontal y el hipocampo, pero sí un aumento significativo sólo en Gα12.101
Desde hace tres décadas se conoce que los antidepresivos provocan la regulación a la baja de los receptores β-adrenérgicos102 o de otros receptores acoplados a Gs (v. gr. 5-HT4, 5-HT6).91 Dado que Gs estimula a la adenilciclasa (AC) para la síntesis de AMPc, la respuesta adaptativa de los receptores acoplados a Gs se contrapone con la estimulación “rio abajo” de la vía AMPc/PKA inducido por los antidepresivos.91,92 La solución a esta paradoja puede encontrarse en Gαs, sin embargo la evidencia inmunológica no reporta cambios en la expresión de Gαs.97,98,99,100 Por lo anterior, empleando las neuronas noradrenérgicas del ganglio cervical superior de la rata y la técnica de PCR en tiempo real, se encontró que el tratamiento crónico con imipramina aumenta y reduce significativamente la expresión de los transcritos de Gαs y Gαz, respectivamente ( figura 1; datos sin publicar). El robusto cambio en la expresión de Gαs y Gαz, de darse en el SNC, podría contribuir al efecto estimulante de los antidepresivos sobre la vía del AMPc.
C) Efecto sobre la glicógeno sintasa cinasa 3β (GSK-3)
El interés por la proteína pro-apoptósica GSK-3 como blanco de los antidepresivos surge de varios hallazgos: a) se conoce que el litio, un ión con propiedad antimaniaca, es un inhibidor de esta enzima,103 al impedir su interacción con el complejo β-arrestina-fosfatasa2A-Akt;104 b) la mayor actividad de GSK-3 está asociada a alteraciones en la plasticidad neuronal, la estructura y la sobrevivencia celular; c) estudios post-mortem revelan un aumento de la actividad de GSK-3 en la CPF de individuos con DM105 y d) la activación del receptor 5-HT1A resulta en la fosforilación e inhibición de GSK3, en el hipocampo y la corteza del ratón.76 Si bien el agonista serotoninérgico d-fenfluramina o la fluoxetina y la imipramina inhiben a la GSK-3 en la CPF, el hipocampo y la estriado,106 es prematuro concluir que la inhibición de la GSK-3 contribuya al efecto terapéutico de los antidepresivos porque su fosforilación alcanza el máximo de 30 a 60 min después de la inyección de d-fenfluramina o fluoxetina, decayendo a su nivel basal en las siguientes horas.106
D) Efectos epigenéticos
Recientemente la epigenética ha aportado un conocimiento adicional sobre la patogénesis de la DM y el mecanismo de acción de los antidepresivos.107 En este enfoque se le atribuye al estrés crónico un papel relevante en la interacción del medioambiente con la carga génica del individuo, siendo la acetilación (activador de la expresión) y/o la metilación (inhibidor de la expresión) de las histonas el mecanismo molecular por el cual el estrés modifica el patrón de expresión génica.
Tsankova et al.108 encontraron que el estrés por rechazo social inhibe en el hipocampo del roedor la expresión de BDNF y aumenta la metilación de la histona H3-K27; en tanto que la imipramina revierte el efecto sobre el BDNF al inhibir la expresión de la histona deacetilasa-5 (Hdac5) generando subsecuentemente un aumento en la acetilación de la histona H3. Consistentemente con lo anterior, la sobreexpresión en el hipocampo de Hdac5 revierte el efecto conductual de la imipramina, la cual promueve la conducta de socialización.108 Otro estudio muestra que la infusión en el NAc del inhibidor de las Hdac, el MS-275, tiene efectos antidepresivos en las pruebas de rechazo social y FST.109
El mecanismo epigenético también contribuye a la vulnerabilidad al estrés. Por ejemplo, el estrés social produce en el NAc aumento en la metilación de 1285 genes; notablemente la imipramina revierte el grado de metilación con un perfil génico semejante al encontrado en los ratones que toleran la presencia del macho agresivo.110 Uchida et al.,111 empleando dos cepas de ratones, una vulnerable (BALB/c) y otra resistente (C57BL/6) al estrés crónico físico, sugieren que uno de los genes cuyo nivel de expresión se correlaciona con la vulnerabilidad o la tolerancia al estrés es el del factor neurotrófico derivado de la glia (GDNF). Por ejemplo, la cepa BALB/c responde al estrés reduciendo tanto la acetilación de H3 como la expresión del GDNF (estos efectos se revierten con la imipramina); en contraste, la C57BL/6 responde de manera opuesta al estres.111 Las pruebas conductuales revelan que el nivel de expresión del GDNF se correlaciona positivamente con la prueba que valora la conducta de interacción social y hedónica, pero no con la FST. Estos hallazgos sugieren que en el humano algunas conductas depresivas tienen su base molecular en cambios en el nivel de expresión de genes específicos y en áreas definidas del SNC.
E) Otros blancos moleculares
Otra proteína cuya expresión es inhibida por la imipramina es la proteína p21.112 Esta proteína es un inhibidor de las cinasas dependientes de ciclinas y, por ende, regula la proliferación celular. Se postula que la inhibición de la expresión de p21 es parte del mecanismo mediante el cual los antidepresivos estimulan la neurogénesis en el hipocampo.112 Sin embargo, no es claro si la neurogénesis en el hipocampo es indispensable para el efecto antidepresivo observado en la prueba FST. Lo anterior se plantea porque cuando se inhibe la neurogénesis por irradiación con rayos X del hipocampo, la fluoxetina continúa ejerciendo su acción antidepresiva en la prueba FST.113
Otro blanco molecular de los antidepresivos es la proteína p11. Esta molécula de señalización interacciona con los receptores 5-HT1B y 5-HT4, y su expresión está reducida en la CCA y NAc de pacientes con DM.114 En el roedor, la fluoxetina, la imipramina y la tranilcipromina, pero no el NSRI desipramina, estimulan la expresión de p11 en la corteza frontal y el hipocampo.114,115 Además, citoquinas como el interferón-γ y TNF-α aumentan la expresión de p11.115 Se desconoce el grado de entrecruzamiento de las vías de señalización estimuladas por las citoquinas (efecto en cuatro hrs) y los antidepresivos (efecto en 14 días). Otro dato revelador es que los fármacos anti-inflamatorios no esteroideos (NSAIDs) reducen la eficacia de los SSRIs para aumentar la expresión de p11, y este antagonismo se extiende a su efecto antidepresivo en la prueba FST y la DM.115 En contraste, los NSAIDs aumentan la eficacia terapéutica del NSRI reboxetina.116 En conjunto todos estos hallazgos sugieren que existe una divergencia en el mecanismo molecular que subyace a la acción terapéutica de los SSRIs y los NSRIs.
Conclusión
Distintos mecanismos pueden causar el déficit de la transmisión serotoninérgica. En algunos casos tiene bases genéticas como el polimorfismo G1463A en el gen de la enzima hTPH2 o el C(-1019)G en el gen del receptor 5-HT1A; el primero reduce la síntesis de 5-HT mientras que el segundo atenúa su liberación. Desde esta perspectiva se sugiere que el diagnostico de DM incluya un estudio de genética molecular para identificar estos polimorfismos. Además, se infiere que los portadores del polimorfismo C(-1019)G responderán mejor a la combinación de SSRI con algún antagonista del 5-HT1A. La menor densidad postsináptica del receptor 5-HT1A también es un mecanismo fisiopatológico relevante porque su acción inhibitoria sobre la excitabilidad neuronal es consistente con el hipermetabolismo del área Cg25 y la amígdala. Estos cambios metabólicos pueden revelar la disfunción de los circuitos intra-corticales y límbico-corticales ( figura 2). En este contexto, se sugiere que el diagnóstico se acompañe de un estudio con PET, para confirmar la menor densidad cortical del 5-HT1A.
Los estudios pre-clínicos indican que el estrés reduce la expresión del BDNF y GDNF, del receptor 5-HT1A, y provoca atrofia dendrítica en el hipocampo. El efecto sobre la expresión de los factores de crecimiento opera mediante mecanismos epigenéticos, ya sea aumentando la metilación o reduciendo la acetilación de la histona H3. La imipramina revierte estos efectos al inhibir en el hipocampo la expresión de la Hdac5 y, por ende, aumentando la acetilación de H3 y la expresión del BDNF. En el NAc el tricíclico reduce la expresión de Hdac2, aumentando la expresión del GDNF. La latencia de los efectos epigenéticos de la imipramina coincide con la latencia de su acción terapéutica. Es probable que el efecto inhibitorio del estrés sobre la expresión del 5-HT1A sea por un mecanismo epigenético. En el hipocampo el receptor 5-HT1A también tiene efectos proliferativos y neurogénicos, aunque se desconoce si el BDNF interviene en la acción del receptor.
Un efecto celular común de los antidepresivos es la estimulación de la vía AMPc/PKA y la subsecuente estimulación de genes regulados por el factor de transcripción CREB, incluyendo el BDNF. Aquí demostramos que la imipramina aumenta la expresión de Gαs (estimulador de la AC) y reduce la expresión de Gαz (inhibidor de la AC). Estos cambios en la expresión son consistentes con la estimulación de la vía del AMPc.
El efecto clínico antagónico de los NSAIDs sobre los SSRIs, pero no sobre los NSRIs, sugiere que es relevante identificar con mayor precisión la etiología de la DM para definir (SSRIs vs. NSRIs) la apropiada estrategia farmacológica.
Financiamiento
Este trabajo fue parcialmente subvencionado por el Consejo Nacional de Ciencia y Tecnología (donativo 168734).
Conflictos de interés
Los autores declaran no tener conflictos de interés.